Доклад №2
Можно часто услышать жалобы на жесткую воду и проблемы с ней связанные. Что же такое «жесткая вода»? Какие проблемы она несет? Как смягчить воду?
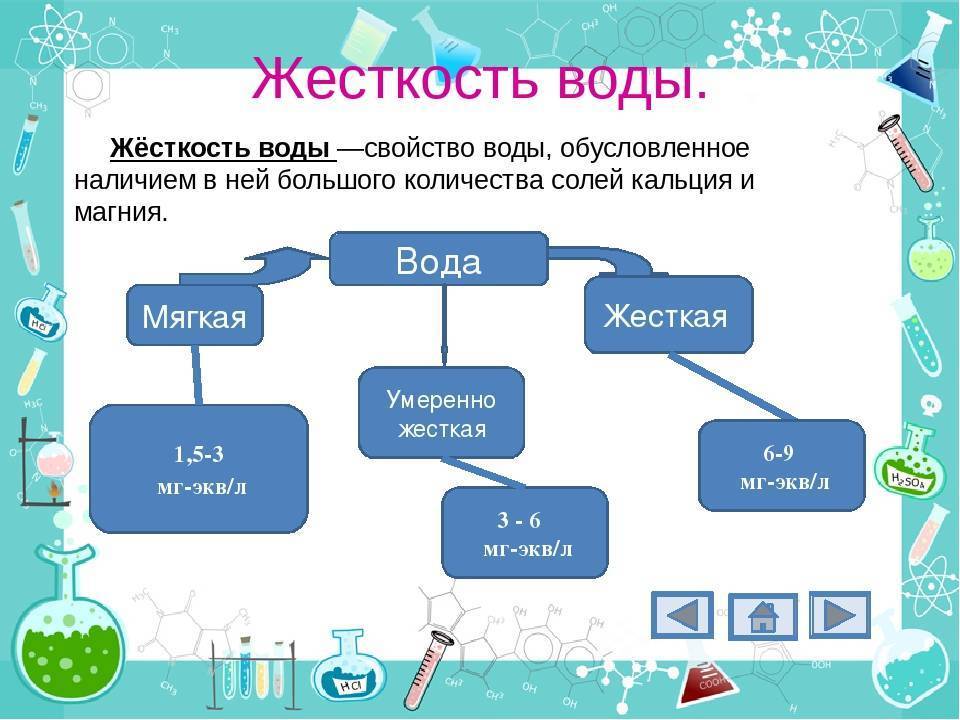
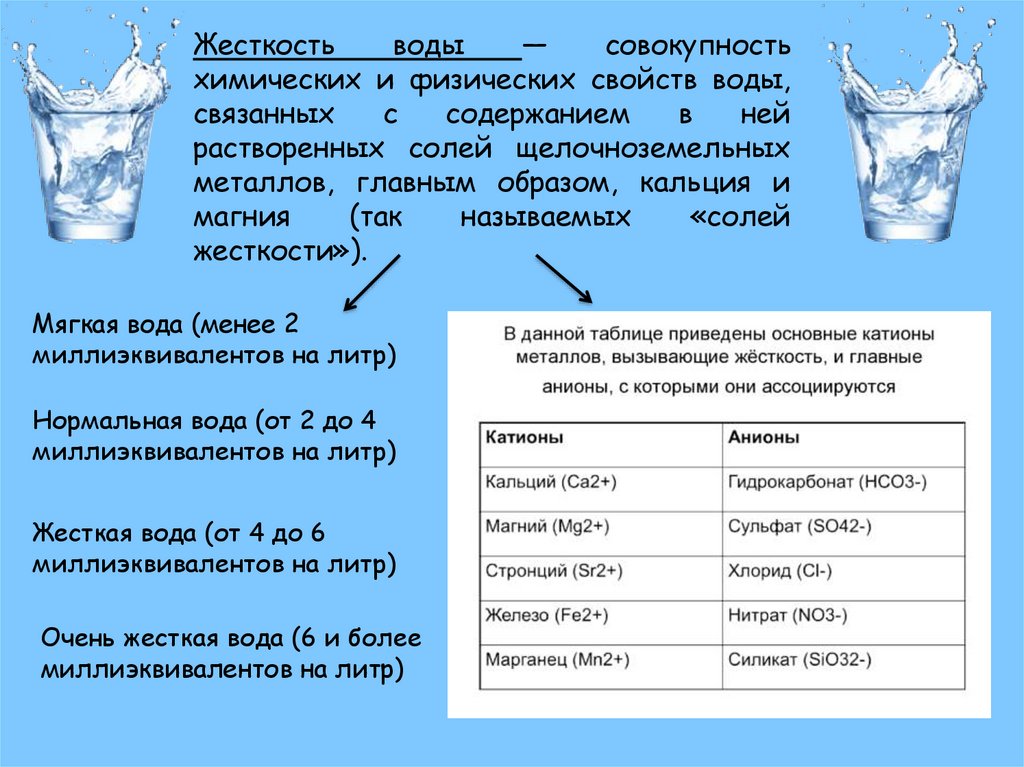
Жёсткость воды – свойства воды, связанные с содержанием в ней солей жесткости. При большом количестве солей щёлочноземельных металлов в воде она называется жесткой (название произошло от того, что после стирки в такой воде ткань более жесткая). Показатель жесткости воды различен и изменяется в течение года, для его контролирования в России установлен специальный стандарт.
Жесткая вода приносит человеку много неприятностей. В ней плохо пенится мыло, она губительно действует на кожу, создает накипь на стенках котлов, чайников, труб, способствует образованию камней в мочевом пузыре и почках.
Существует несколько способов борьбы с жесткой водой, но все они имеют свои плюсы и минусы.
Термический. При кипячении воды гидрокарбонаты магния и кальция разлагаются.
- Временное смягчение воды
- Выгодно применять в домашних условиях
- Отсутствие специального оборудования
- Образуется накипь.
Реагентное умягчение. В воду добавляются реагенты: кальцинированная сода, гашеная известь или ортофосфат натрия, в итоге соли жесткости выпадают в осадок.
Смягчение воды
- Невыгодность способа в домашних условиях
- Необходимость в реагентах
- Необходимость отделения осадка.
Катионирование. В воду помещают ионообменную гранулированную загрузку, которая поглощает катионы солей щёлочноземельных металлов и отдает ионы натрия и водорода.
Смягчение воды
- Невыгодность способа в домашних условиях
- Сложность способа.
Обратный осмос. Вода проходит через полупроницаемые мембраны, которые удаляют из жидкости практически все соли.
Большая эффективность (99,9%)
- Вода очищается от всех солей, а не только от солей жесткости
- Высокая стоимость, частая смена мембран
- Невыгодность способа в домашних условиях
- Предварительная подготовка воды.
Электродиализ. Такой процесс смягчения воды имеет большое сходство с обратным осмосом, но проходит под воздействием электрического поля.
- Большая эффективность
- Редкая смена мембран
- Отсутствие предварительной подготовки воды.
- Вода очищается от всех солей, а не только от солей жесткости
- Невыгодность способа в домашних условиях
Дистилляция. Воду нагревают, она испаряется, охлаждается и конденсируется.
- Большая эффективность
- Можно применять в небольших объемах (домашних условиях)
- Вода становится дистиллированной
Жесткая вода часто причиняет неудобства человеку, но существует множество способов, помогающих избавиться от излишней жесткости воды. Все методы имеют свои недостатки и преимущества, и каждый выбирает себе тот, который ему подходит.
9 класс
Как повысить и понизить жесткость воды в аквариуме. Определение временной, или карбонатной жесткости
Как понизить жесткость воды в домашних условиях
Существуют разные методы удаления отложений солей. В домашних условиях можно воспользоваться теми, которые не предполагают финансовых или временных затрат. Естественно, что подобные способы не гарантируют стопроцентного избавления от вредных веществ.
Наиболее распространенным методом считается кипячение. Снизить концентрацию солей способна термическая обработка. Этот способ вызывает массу нареканий у специалистов. Во-первых, при кипячении избыток веществ оседает на стенках посуды, в которую помещен раствор. Накипь очень трудно отмыть. Во-вторых, после кипячения из напитка вымываются не только вредные компоненты, но и полезные. Человеку нельзя употреблять только термически обработанную воду, поскольку недостаток микроэлементов пагубно скажется на здоровье.
Еще один доступный способ – отстаивание. Соли осядут на дне емкости, но их концентрация снизится незначительно. Поэтому такой метод считается не самым эффективным.
Если требуется смягчить раствор, предназначенный для стиральной машины, используйте специальные магазинные средства. Они выпускаются в виде таблеток и используются при каждой стирке, защищая нагревательные приборы бытовой техники от образования накипи.
Жесткость воды. Соли жесткости
Признаки повышенной жесткости
Что такое жесткость воды? Это показатель, определяющий уровень магниевых и кальциевых солей, которые входят в химический состав жидкости. Единицы измерения — моль/куб.м и мг.экв./литр.
Жесткая вода — частое явление, которое обусловлено влиянием подземных вод, насыщенных солями химических элементов. Кроме того, подобная жидкость может содержать хлоридные и фосфатные соединения, а также различные органические загрязнители.

Чтобы определить жесткость воды своими руками, рекомендуется воспользоваться специальным устройством — кондуктометром, предназначенным для замера параметра электропроводимости жидкости. Высокий показатель указывает на повышенную концентрацию солей металлов в воде.
В процессе кипячения химические соли образуют осадочную массу, но большая часть соединений попадают в человеческий организм, оседают на стенках приборов, техники и оборудования.
Какая же вода будет считаеться жесткой? Основные признаки повышенной концентрации солей следующие:
- моющие средства плохо вспениваются;
- после кипячения образуется накипь и белый налет;
- после стирки вещей и мытья посуды остаются характерные разводы;
- жесткая жидкость приобретает неприятный горький привкус;
- вода оказывает негативное влияние на эксплуатационные характеристики тканей;
- повышенная концентрация солей приводит к заболеваниям выделительной системы, а также к дряблости и сухости кожи.
Описание
Жесткость – одно из важнейших свойств аквариумной воды. Пресная вода содержит соли, в частности, кальция и магния, но в небольшом количестве по сравнению с морской. Жесткость воды определяется количеством этих солей. Жесткая вода свойственна известняковым регионам. Мягкая вода характерна для старых гор, лесистых и болотистых местностей. Многие места планеты известны тем, что вода там очень мягкая (Амазония) или очень жесткая (Центральная Америка, крупные озёра Восточной Африки).
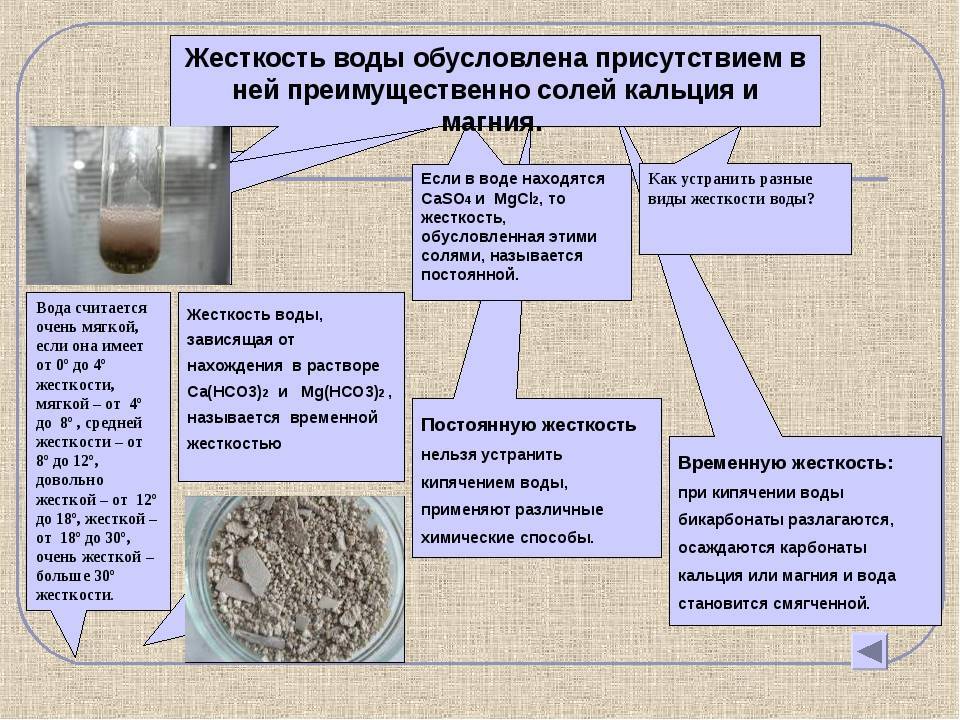
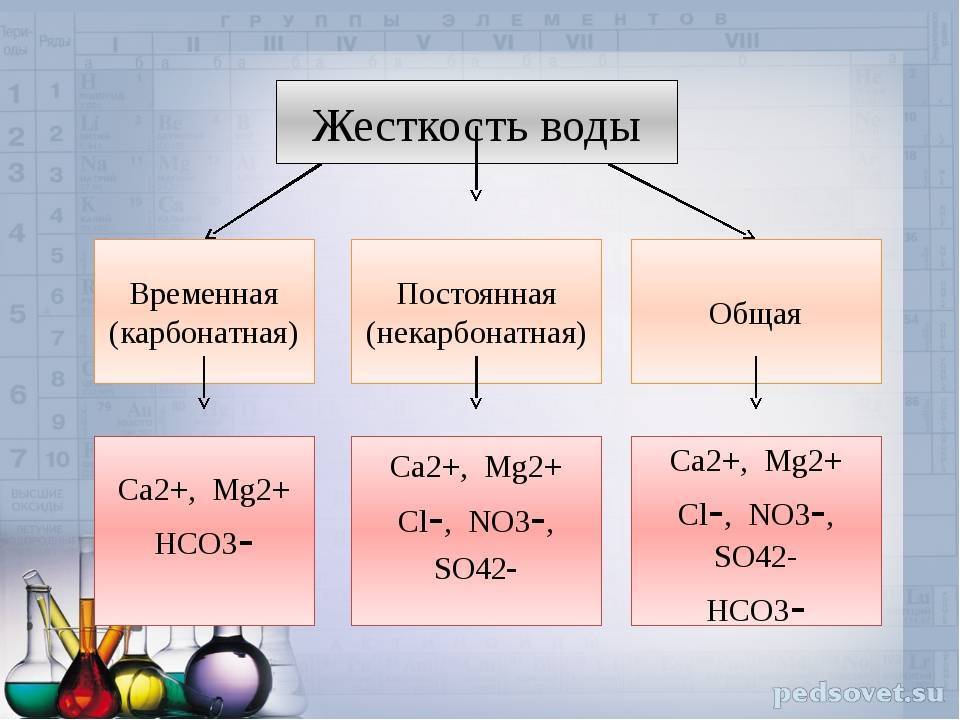
Постоянная жесткость не загрязненных промышленными стоками слабоминерализованных поверхностных природных вод характеризует количество растворенных сульфатов, хлоридов и некоторых других солей кальция и магния. То есть в этих водах наряду с катионами Ca2+ и Mg2+ имеются анионы SO42-, Cl- и др. При кипячении такой воды концентрации этих катионов и анионов практически не изменяются – отсюда и название «постоянная жесткость».
GH — общая жесткость воды. Она характеризует концентрацию всех растворённых минеральных солей (карбонатов, бикарбонатов, сульфатов, хлоридов) и гидроксидов.
KH — карбонатная, или временная жесткость воды. Она отражает только концентрацию карбонатов и бикарбонатов кальция и магния.
В России, да и в большинстве других стран, жесткость измеряется в немецких градусах. Общая жесткость обозначается как dH или dGH, карбонатная — KH или dKH.
§ 68. Жесткость воды и способы ее устранения
Вода, прежде чем попасть в колодец или водопроводную сеть, просачивается сквозь почву и насыщается в ней растворимыми солями.
Природные воды содержат сульфаты и бикарбонаты кальция и магния, т.е. катионы Са2+ и Мg2+, анионы SO42- и НСО3-. Вода, в которой содержание ионов Са2+ и Mg2+ незначительно, называется мягкой, вода с повышенным содержанием их – жесткой.
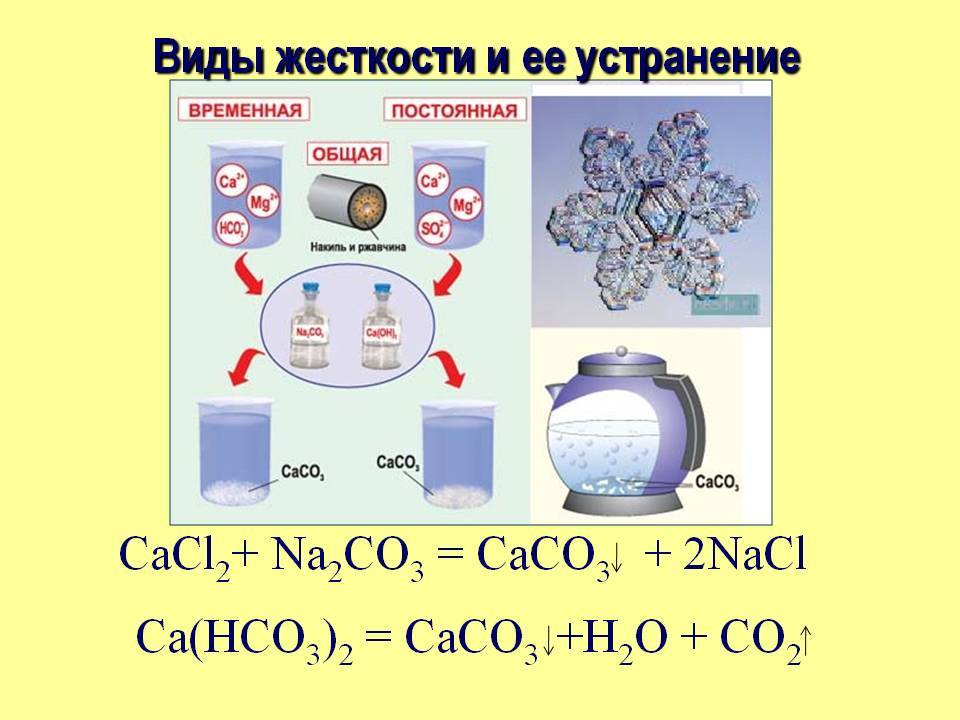
При кипячении жесткой воды бикарбонаты разлагаются, образуя нерастворимые карбонаты, например:
Карбонаты осаждаются, и жесткость воды уменьшается. Жесткость, вызываемая содержанием в воде бикарбонатов кальция и магния, называется карбонатной или временной. Жесткость, обусловленная присутствием прочих солей кальция и магния и сохраняющаяся после кипячения воды, называется некарбонатной или постоянной.
Широко известно, что в жесткой воде мыло плохо мылится. Изучим это явление на опыте, взяв в качестве искусственной жесткой воды, например, раствор гипса. Нальем в бюретку разбавленный раствор мыла и будем приливать его понемногу, порция за порцией, к жесткой воде, сильно встряхивая после каждого приливания стакан с жесткой водой. Первые порции мыла будут затрачиваться на образование хлопьевидного осадка, и пены при встряхивании получаться не будет. Только после того, как прекратится образование осадка, появится пена.
Мыла – это натриевые (иногда калиевые) соли органических кислот, и их состав можно условно выразить формулой NaR или KR, где R – кислотный остаток. Анионы R- образуют с катионами кальция и магния нерастворимые соли CaR2 и MgR2. На образование этих нерастворимых солей и расходуется бесполезно мыло. Таким образом, при помощи мыльного раствора мы можем оценить общую жесткость воды, общее содержание в ней ионов кальция и магния.
Для хозяйственно-бытовых нужд требуется вода С незначительной жесткостью. При кипячении жесткой воды образуется накипь. В жесткой воде плохо развариваются мясо, овощи, крупа. При стирке тканей жесткой водой образующиеся нерастворимые соединения осаждаются на поверхности нитей и постепенно разрушают волокна.
При питании паровых котлов жесткой водой образуется накипь. Накипь затрудняет нагревание воды, вызывает увеличение расхода топлива, ускоряет изнашивание стенок котла (рис. 57).
Рис. 57. Разрез трубы водяного отопления. Просвет почти забит накипью
Для понижения жесткости воды применяют различные методы. Перед направлением в паровой котел воду предварительно нагревают, чем устраняют временную жесткость. Для питания котлов высокого давления в настоящее время часто применяют перегнанную (дистиллированную) воду. Для понижения жесткости воды используют химические методы, приводящие к переводу ионов кальция и магния в состав нерастворимых солей, обычно в карбонаты.
Карбонатную жесткость устраняют добавлением известкового молока:
Са(НСО3)2 + Са(ОН)2 = 2СаСO3↓ + 2Н2O
Некарбонатная жесткость устраняется добавкой соды:
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4
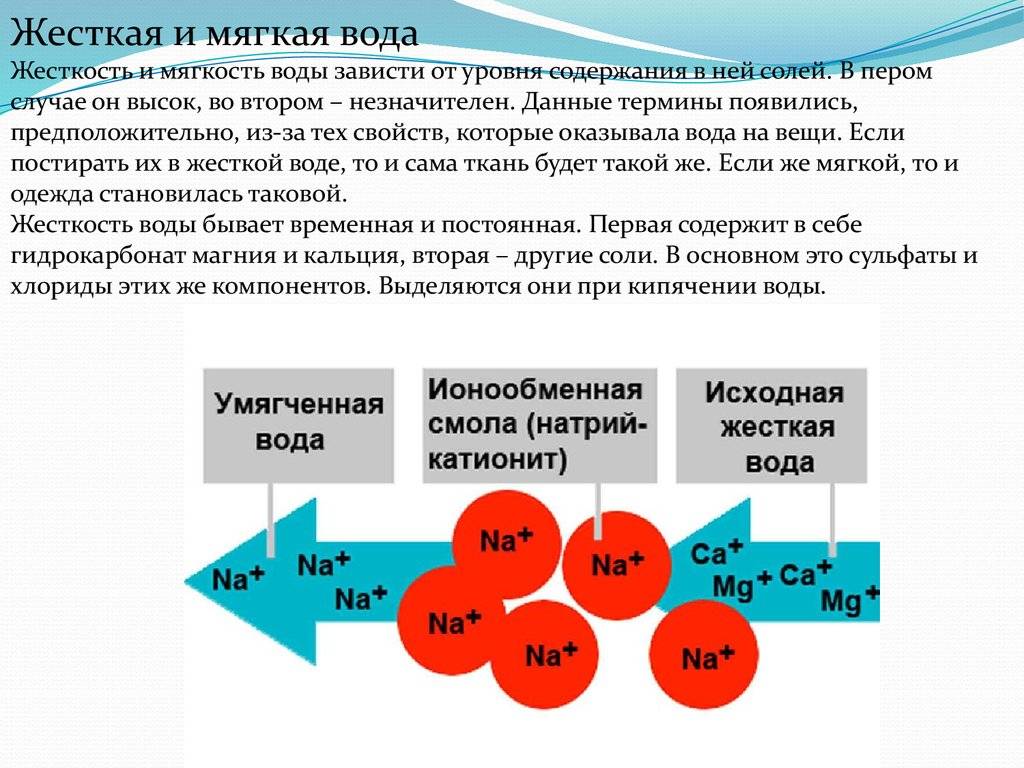
Природную воду, содержащую ионы кальция Са2+ и магния Mg2+, можно смягчить, освободить от этих ионов, заменив их, например, ионами натрия, при помощи ионообмена. Для этого воду на станциях водоочистки пропускают через ионнообменную колонку с катионитом, содержащим подвижные ионы Na+. Ионы кальция и магния удержатся в катионите, а в воду перейдет из катионита эквивалентное количество безвредных ионов натрия:
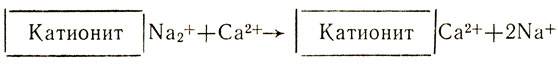
- Какая вода более жесткая: дождевая или речная? Почему?
- Объясните, почему в речной воде содержатся бикарбонаты кальция и магния.
- Как частично смягчить воду, не применяя химических реактивов?
- Напишите в ионной форме уравнения реакций, применяющихся при устранении: а) карбонатной жесткости, б) некарбонатной жесткости.
- Почему постоянную жесткость, обусловленную содержанием в воде гипса, нельзя устранить добавкой гидроокиси кальция?
- Испытайте разными способами на жесткость пробы воды, взятые из разных окрестных источников.
- * Чистую воду получают иногда не путем перегонки природной воды, а пропуская ее последовательно через две колонки, содержащие: одна – катионит, “заряженный” ионами водорода, а другая – анионит, “заряженный” ионами гидроксила. Объясните, каким образом при такой обработке вода освобождается от любых катионов и анионов и становится химически чистой.
Основные причины образования жесткости воды
Фактически эта жидкость является универсальным растворителем, который при контакте с почвой и минералами насыщается содержащимися в ней веществами и химическими соединениями. Отвечая на вопрос о жесткости воды, и чем она обусловлена, необходимо выделить основные источники солей щелочноземельных металлов:
- Для подземных источников — это пласты известняка, сквозь которые просачивается жидкость.
- Для открытых водоемов и приповерхностных слоев — это геологические породы: природный гипс, доломит и другие.
- Ионы кальция и магния насыщают воду в результате химических реакции диоксида углерода и некоторых минералов.
- Микробиологические процессы в грунтах и на сельскохозяйственных угодьях в районах водосбора.
Помимо естественных причин повышенное содержание ионов жесткости в воды обусловлено также и техногенными. В составе стоков промышленных, строительных и коммунальных предприятий имеется большое количество примесей. В результате происходит вторичное загрязнение водоемов и водоносных слоев.
Естественные процессы химического выветривания горных пород и техногенные факторы определяют параметры жесткости воды питьевой или технической. Эти показатели неодинаковы для различных источников и постоянно изменяются:
- Повышаются в результате испарения влаги с открытых поверхностей водоемов.
- Снижаются при выпадении атмосферных осадков, таянии льдов и снега.
Значительное содержание извести в воде — это жесткость преимущественно естественного происхождения, характерная для подземных источников, в том числе и для артезианских скважин. Минерал вымывается из геологических пластов потоками жидкости при просачивании вглубь земной коры. Затем этот раствор через родники и ключи пополняет водный баланс открытых источников.
Происходит постоянный кругооборот, и жесткость воды в некоторой степени зависит от времени года. Весной в ходе таяния снегов и активных осадков он существенно уменьшается в другие периоды и, особенно при засухах — увеличивается.
Твердость природной воды
- Твердость природной воды колеблется в широких пределах; она неодинакова в разных природных водах, в одном и том же водном объекте величина ее изменяется по временам года. В поверхностных водах Т. достигает наибольших величин в конце зимы, маленьких — в период половодья. В поверхностных водах обычно преобладает карбонатная Т. (70-80% общей). Магниевая Т.В. редко превышает 30% общей, однако в некоторых районах (Донбасс, Кривой Рог) достигает 60% общей. Т. подземных вод, особенно в артезианских колодцах, меньше изменяется в течение года.
- Твердость речных вод Украины, как и минерализация воды возрастает с северо-запада на юго-восток. В речных водах Полесья твердость составляет 2-3 ммоль / дм³, в Днепре — 4-5 ммоль / дм³, а в малых и средних реках Приазовья — 15-30 ммоль / дм³, что ограничивает возможности использования местных водных ресурсов.
- Твердость морской воды: Черное море — кальциевая 12,0 ммоль / дм 3, магниевая 53,5 ммоль / дм 3, общая 65,5 ммоль / дм3; Каспийское море — кальциевая 36,4 ммоль / дм 3, магниевая 30 ммоль / дм 3, общая 66,4 ммоль / дм3; океан — кальциевая 22,5 ммоль / дм 3, магниевая 108 ммоль / дм 3, общая 130,5 ммоль / дм3.
Как определить жесткость воды в домашних условиях подручными средствами?
- Более простым способом можно определить жесткость воды при помощи обычного мыла. Этот показатель весьма приблизительный, но он быстро показывает, если вещь в мыльном растворе плохо мылится, а при смывании покрывается хлопьевидным налетом, значит вода жесткая! А чем мягче вода, тем лучше пена.
- Также хорошим тестом на жесткость воды является крупнолистовой чай (именно листовой, а не гранулированный), который при заваривании в жесткой воде получается мутным, с темным цветом и имеет неприятный привкус – сказывается влияние большого количества солей в воде. К тому же, пенка на поверхности чая – это тоже сигнал о жесткости. Обычно она появляется после несколько часов.
- Накипь на чайнике, стиральной машинке, тех же трубах и кранах — жесткая вода будет постоянно и очень быстро создать налет, который будет разъедать эмаль.
- Можно капнуть на стекло или зеркало каплю воды. Наличие любого белого или желтого налета укажет на повышенную жесткость.
- Изобилие солей препятствует развариванию картофельных и мясных блюд.
- И, как последний простой совет, попробуйте воду на вкус. Прокипятите воды, желательно около 5 минут. После охлаждения попробуйте: Сладкий вкус – много гипса
- Горький – кристаллов магния
- А терпкий – изобилие железа
Самое простое определение
Характеристики жесткой воды
Для организма человека жесткая вода с большим содержанием кальция становится даже полезной, так как она наполняет его жизненно важным для костей элементом. Но помимо этого жесткая вода может спровоцировать формирование камней в мочевыводящих каналах и в почках, а мягкая – повышает риск возникновения сердечнососудистой патологии
При умывании кожи жесткой водой она начинает сушиться, а при использовании мыла оно плохо пенится. На трубах и чайниках быстро образуется накипь. Но и мягкая вода не так полезна, как кажется – её использование может спровоцировать коррозию труб и других устройств.
Для бытовых приборов большая жесткость воды часто оказывается губительной, особенно для стиральных машин. Для предупреждения поломки машинки или электрического чайника необходимо использовать в быту фильтры для воды. При поломке ремонт будет стоить недешево, поэтому лучше заранее уберечься от ненужных растрат.

В высокоминерализованной воде концентрация ионов магния может равняться нескольким граммам, а в соленой воде – даже десяткам грамм на литр воды.
Что касается сравнения подземных и поверхностных вод, то у последних жесткость намного меньше, зато она подвергается изменениям погоды, максимально увеличиваясь в конце зимы, а уменьшаясь – во время половодья, когда разбавляется дождевыми и талыми водами. Максимальная жесткость отмечена в воде морей и океанов.
Дополнительные варианты определения жесткости

Есть и другие методы того, как определить жесткость воды. Правда, они не могут похвастаться точностью. Зато с их помощью вы сможете определить, жесткая ли у вас вода или все показатели в пределах нормы.
- Вскипятите небольшое количество воды, остудите до комнатной температуры (примерно 20-22 °С). Попробуйте воду: если она горькая и терпкая, в жидкости содержатся соли магния и железа в большом количестве.
- Посмотрите на ваш чайник, бройлер и другие нагревательные приборы. Присутствует белый или желтый налет? Возникает он не моментально. Если за 1,5-2 месяца появляется накипь, уровень жесткости вашей воды – около 11 °dH (средняя жесткость). За более короткий срок – от 18 °dH и выше.
- Возьмите кусок мыла и умойтесь. Удалось ли смыть пену? Не сушит ли кожу? Если ответ положительный, у вас мягкая вода или средней жесткости.
Нормы жесткости для воды
Нормирование определяется документами стандартизации: ГОСТ, СанПиН, ТУ. Точные данные получают, проводя испытания проб в аккредитованных лабораториях, в санэпидстанциях. Для фиксирования лабораторных показаний приняты международные единицы измерения жесткости воды:
- моль/м 3 — количество молей на кубический метр жидкости;
- мг-экв/л — миллиграмм-эквиваленты на кубический дециметр (на 1 литр);
- °Ж — градус жесткости.
Измеряемая единица жесткости воды 1°Ж равна 1 мг-экв/л и равна 1/2 миллимоля на литр. Допустимые значения для ионов кальция и магния разные: для Ca2+1°Ж=20,04, для Mg2+1°Ж=12,16 мг/л (примечание: эти показатели вставляются в расчетную формулу, см. далее по тексту*).
По структуре вода может быть мягкой, средней, жесткой. Мягкой считается дистиллированная, кипяченая, дождевая, талая водичка. Жидкость средней жёсткости поступает из централизованных водопроводов. Артезианская и родниковая водица тоже отличаются средними показателями. К сильножесткой относится вододобыча из соленых водоемов, нуждающаяся в опреснении. В таблице показаны концентрации солей в разных размерных единицах.
Предельно допустимое содержание солей жесткости в воде
| Степень жесткости воды | Показатель в мг-экв/л | Показатель в °Ж | Показатель в ppm |
| Слишком мягкая | до 1,5 | до 1-1,5 | 0-70 |
| Мягкая | 1,5-4 | 1,6-4 | 71-140 |
| Среднежёсткая | 5-8 | 5-12 | 141-210 |
| Сильножёсткая | 9-12 | 13-22 | 211-320 |
| Сверхжёсткая | свыше 12 | 23-34 | 321-530 |
Профессиональные методы снижения жесткости воды
Качественное умягчение исходной воды до требуемого уровня возможно только при использовании специального оборудования — фильтров от жесткости воды. Довести показатели жесткости до соответствия требованиям упомянутого СанПиН и «ГОСТ вода питьевая» позволяют следующие технические устройства:
- Фильтры умягчения.
- Ионообменные фильтры.
- Системы обратного осмоса.
При выборе установки для снижения жесткости воды, прибором для ее определения устанавливают точный гидрохимический состав и количественное содержание солей. Оборудование подбирается по результатам испытаний и с учетом требований заказчика к качеству обработанной воды.
Фильтры умягчения
Процесс уменьшения общей жесткости воды должен быть достаточно эффективным и недорогим. В настоящее время основным способом умягчения является метод натрий-катионирования (фильтры умягчения), который применяется и в быту, и в промышленных масштабах. Поток воды пропускается через ионообменные колонны, где происходит замещение кальция и магния катионами натрия. На поверхности полимерных смол происходят следующие химические реакции:
Ca2+ + 2RNa = 2Na+ + R2Ca
Mg2+ + 2RNa = 2Na+ + R2Mg
В результате общая жесткость доводится до уровня питьевой воды по ГОСТу, что делает возможным ее применение для приготовления пищи и хозяйственно-бытовых нужд.
Такие фильтрующие колонны применяются в составе многоступенчатых систем, в которых вода сначала очищается от механических примесей и железа. Это позволяет повысить ресурс основных картриджей, который естественным образом уменьшается в процессе расходования ионов натрия и накопления ионов жесткости. Для восстановления свойств ионообменных смол в системе предусмотрены баки с раствором поваренной соли, клапаны и блоки управления.
Когда датчик фиксирует повышение жесткости воды в ppm, подача ее перекрывается и производится обратная промывка содержимого колонны солевым раствором. После восстановления характеристик полимерных гранул, подача реагента прекращается. Открывается клапан и возобновляется процесс умягчения.
Управление работой такого фильтра, обеспечивающего уменьшение общей жесткости природной воды, в зависимости от комплектности осуществляется в автоматическом или в ручном режиме. В первом варианте используются электронные датчики и электроклапаны. Во втором случае переключение установки в режим регенерации выполняется человеком по истечении определенного периода времени.
Ионообменные фильтры
Данный метод умягчения по принципу действия в значительной мере аналогичен описанному выше. Замещение ионов, обуславливающих жесткость воды, в них происходит с помощью многокомпонентных смол типа Ecomix или Ecotar. В состав этих фильтрующих загрузок входят следующие материалы:
- Смола инертная обеспечивает обезжелезивание воды.
- FerroSorb удаляет соединения железа и марганца.
- HumiSorb нейтрализация органических примесей.
- Смола ионообменная для умягчения воды.
- Песок кварцевый в виде подложки, обеспечивающей равномерное распределение потоков жидкости.
Применение многокомпонентных составов для фильтрующих установок позволяет снизить общую жесткость воды за счет реакции замещения катионов кальция и магния. Данная технология более универсальна в сравнении с фильтрами умягчения, однако и менее эффективна. При этом финансовые затраты на ее приобретение и содержание выше нежели у специализированных элементов.
Обратный осмос
Использование полупроницаемых мембран обеспечивает высочайший уровень очистки жидкости от всех видов примесей. В современных системах обратного осмоса показатели общей жесткости воды после кондиционирования на мембранах типа DRO-4040 или DRO-8040 снижаются более чем на порядок. Такие установки применяются для опреснения соленых воды (океанских, морских, озерных и подземных).
Мембраны имеют пористую структур, пропускающую только молекулы воды и задерживающую соединения кальция и магния (гидрокарбонатные и соли кислот). В результате происходит снижение общей жесткости воды до значений, делающих возможным ее применение в фармацевтике и микроэлектронике. Пермеат практически не содержит микроэлементов и нуждается в минерализации для питья и приготовления пищи.
Такие показатели, существенно превосходящие ГОСТ для питьевой воды по общей жесткости, явно избыточны. С учетом высоких начальных затрат на приобретение, монтаж и последующее обслуживание использовать установки обратного осмоса в быту экономически невыгодно. Гораздо эффективнее для таких целей применять традиционные фильтры умягчения.


















![§ 68. жесткость воды и способы ее устранения [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](https://mirribaka.ru/wp-content/uploads/8/6/2/8623e5cc2cba58e366dd91a671799693.webp)